「明日のプレゼンうまくいくかな」
「本番で失敗しないかな」
日常生活や仕事の様々な場面において、私たちは不安を感じる瞬間があります。
基本的に不安によって生活に支障が出ることはありません。ですが、例えばあがり症の人では、仕事に支障が出るかもしれませんよね。他にも生活習慣病やがんを抱えている人では、先行きが不安となり、生活に対する気力が低下するといったこともあるでしょう。
不安がなくなったら、どんなに楽になることか。そう思う人たちにとって、不安の有無は大いにQOLに直結すると言えます。
そんな不安に対し、海外ではCBD(カンナビジオール)や医療用大麻が有効である可能性が示されています。
この記事では不安についての基礎知識、CBDと医療用大麻の有効性についてお話していきます。
目次
不安とは?
不安は危険な状況に対応するための脳の反応であり、生きていく上で極めて重要な感情です。
例えば目の前にクマが現れたとしましょう。危険だと認識し不安や恐怖を感じなければ、平然とクマに近寄り襲われてしまうかもしれません。
このように、不安や恐怖は危険を回避するため、つまりは命を守るために不可欠な反応となります。なお、対象がはっきりしていないものを不安、対象がはっきりしているものを恐怖と呼びます。
ただし不安が必要とはいえ、ささいなことで強い不安を感じたり、それが長時間持続している状態では生活に支障がでてしまいます。これは病的な不安であり、不安障害と呼ばれます。
日本における不安障害の生涯有病率は9.2%であり、精神疾患の中でも最も身近なものであると言えます。思春期や青年期で発症することが多く、男性より女性の方が有病率が高くなっています(男性:女性=1:2)。
不安のメカニズム
不安は原始的な脳と呼ばれる大脳辺縁系にある扁桃体が興奮することにより生じます。原始人は猛獣と出くわした際、命を守るために逃げるか戦うかを瞬時に判断しなければなりませんでした。この時脳内ではノルアドレナリンの分泌が活発となり、扁桃体が興奮している状態となります。
一方、人は時代とともに新しい脳と呼ばれる大脳皮質を発達させ、理性を働かせることができるようになりました。
扁桃体は瞬時に反応するため、時には誤認することがあります。例えば、おもちゃのゴキブリを目の前に急に出されたら誰しもびっくりするでしょうが、それがおもちゃだと理解できれば不安や恐怖はなくなるはずです。このことは理性が不安を抑制することを意味しています。
不安障害では、理性と感情のバランスが崩れ、扁桃体が過剰に興奮している状態となっています。多くの場合、不安障害の患者さんは頭(理性)では大丈夫だと思っていても、感情が勝り、強い不安を感じてしまいます。
扁桃体の興奮は神経細胞の興奮によって生じます。神経細胞にはグルタミン作動性ニューロンなどの興奮性神経細胞と、GABA(γアミノ酪酸)作動性ニューロンなどの抑制性神経細胞があり、通常これらの活動はバランスが保たれています。
このバランスを崩すことで有名なのが、ストレスです。
人はストレスを感じると副腎皮質からコルチゾールが分泌され、ストレスに順応するために働きます。ですが過剰なストレスにより長期間コルチゾールにさらされ続けることは、脳にとって有害となります。そうなると神経細胞の興奮と抑制のバランスが崩れ、グルタミン酸の放出が優位な状態となり、扁桃体が過剰に興奮した状態となってしまいます。
また、扁桃体の鎮静にはセロトニンが関与しています。そのため、ストレスなどが原因でセロトニンの分泌が少なくなると、不安を抑える働きが不十分となり、理性で感情をコントロールするのが難しくなります。
不安や恐怖には、扁桃体の隣にある海馬も大きく関わっています。不安や恐怖を経験した際、その不快な記憶は海馬で記憶されます。その後、この記憶に関連することを五感で感じたり思い出したりすると、扁桃体と連動して不安・恐怖反応が出現します。
不安障害の症状
強い不安を感じるだけでなく、過剰なノルアドレナリンにより自律神経のバランスが崩れることで、様々な身体症状も出現します。
精神症状
ソワソワと落ち着かない、集中力の低下、活動を控える、回避的な行動など。
身体症状
発汗、動悸、息苦しさ、口渇、冷えやのぼせ、めまい、胃痛、吐き気、頭痛、肩こり、下痢、便秘、トイレが近くなる、不眠など。
不安障害の原因
不安障害の原因はまだ明らかになっていませんが、性格や遺伝性、環境やストレスなどが複雑に影響し合って発症すると考えられています。
不安障害には後述するように様々な種類がありますが、これらは複数で合併する確率が高くなっています。うつ病などの気分障害の併発も多いですが、不安障害とうつ病が併発すると重症化し、難治性になりやすいと言われています。
不安障害の種類
ここでは全般性不安障害、社会不安障害、パニック障害、恐怖症についてご紹介します。
全般性不安障害
様々な事に対しコントロールできない持続性(数週〜数ヶ月以上)の不安を感じる疾患。特定の対象はなく漠然とした不安が次から次へと頭に浮かび、日常生活に支障をきたします。
肩こり、ふるえ、口渇、動悸、頻脈など多彩な自律神経症状が認められます。
社会不安障害
注目される状況で不安や恐怖を感じることで、動悸、ふるえ、発汗、赤面などの症状が出現し、強い苦痛を感じます。
自分が低く評価されてしまうのではないかという不安が強くなり、次第に人前に出ることを避けるようになり、仕事や学業において支障をきたします。
発症のピークは思春期となっています。
パニック障害
突然激しい動悸や発汗、息苦しさ、めまいなどが出現し、このままでは死んでしまうのではないかと感じるほどの強い不安を感じます(パニック発作)。
「また同じように発作が出るのではないか」という予期不安に駆られ、日常生活が著しく制限されます。
20代前半の若年成人に好発し、女性は男性より2〜3倍発症率が高いとされています。
パニック障害は広場恐怖を伴うことが多いです。広場恐怖とは、一人でいる時に人混みや乗り物の中などでパニック発作が起きるのではないかという強い予期不安を感じ、そういった状況や場所を避けることを指します。
恐怖症
特定のものや状況に対し強い不安や恐怖を感じ、それらを拒絶・回避することにより、日常生活に支障をきたします。先端恐怖症、暗所恐怖症、閉所恐怖症など、〇〇恐怖症と呼ばれるものです。
恐怖症には様々なものがありますが、DSM−5(精神障害の診断・統計マニュアル第5版)では恐怖症は動物型(クモ、犬など)、自然環境型(高所、雷など)、血液・注射・外傷型、状況型(飛行機やエレベーターなど)、その他といった種類に分類されています。
発症のピークは動物型、自然環境型、血液・注射・外傷型は小児期。状況型は若年成人とされています。
不安障害の治療
まずは、ストレスの除去などといった環境調整を試みます。それで改善がみられなければ、薬物療法や精神療法などを組み合わせて治療が行われます。
ただしこれらは根治治療ではなく、あくまで不安や関連する症状を緩和するための治療となります。
薬物療法
不安障害の種類や状況に応じて、ベンゾジアゼピン(チエノジアゼピン)系抗不安薬、選択的セロトニン再取り込み阻害薬(SSRI)、セロトニン1A部分作動薬、ヒスタミンH1受容体拮抗薬を使用します。
ベンゾジアゼピン系抗不安薬
神経の興奮を抑制する作用をもつGABA作動性ニューロンを活性化することにより、抗不安作用や鎮静作用をもたらします。チエノジアゼピン系薬も同様の薬理作用のため、こちらに含めています。
SSRIとは異なり、ベンゾジアゼピン系抗不安薬は効果発現が早いです。よってSSRIの効果が発現するまでのつなぎとして使用されたり、頓服薬として使用されることが多いです。
ベンゾジアゼピン系抗不安薬は半減期(薬の血中濃度が半分になる時間)により短時間型、中間型、長時間型、超長時間型に分類されます。
短時間型
半減期:6時間以下
クロチアゼパム、エチゾラム、フルタゾラムなど
中間型
半減期:12〜24時間
アルプラゾラム、ロラゼパム、ブロマゼパムなど
長時間型
半減期:24時間以上
ジアゼパム、クロルジアゼポキシド、クロキサゾラム、オキサゾラム、メダゼパム、フルジアゼパム、メキサゾラム、クロラゼプ酸二カリウムなど
超長時間型
半減期:90時間以上
ロフラゼプ酸エチル、フルトプラゼパムなど
ベンゾジアゼピン系抗不安薬の副作用
眠気、ふらつきが最も多く、注意力低下、健忘、頭痛、低血圧などがみられることもあります。
ベンゾジアゼピン系抗不安薬の離脱症状
ベンゾジアゼピン系の薬は依存や耐性を形成することがあり、特にこれは短時間型でよくみられます。そのため、不要な服用や連用は避け、症状が消失したらできる限り早期に服用を中止するのが望ましいとされています。
ですが、ベンゾジアゼピン系薬にとって代わるような薬がないという事実もあり、実際の臨床の現場では連用することが珍しくありません。
ベンゾジアゼピン系薬により依存が生じると、脳が鎮静された状態が当たり前となってしまいます。そのため、急に中止したり極端に減薬すると、その当たり前の状態が崩れてしまい、からだに不調をきたします。ひどいと不安、焦燥感、ふるえ、しびれ、けいれん、動悸、頭痛といった多彩な症状が認められ、生活に支障が生じます。
それゆえに、ベンゾジアゼピン系抗不安薬を中断するには、徐々に服薬回数を減らしていくなどの工夫が必要です。これには最短でも6ヶ月はかかるとされています。他にも依存を形成しやすい短時間型から、依存性の少ない長時間型や他の抗不安薬へと置換し、最終的に中止するといった方法もとられます。
選択的セロトニン再取り込み阻害薬(SSRI)
セロトニンの再取り込みを阻害することによって、脳内のセロトニンの量を増やし、セロトニン1A受容体を活性化することにより、抗不安・抗うつ作用をもたらします。SSRIはうつ病の第一選択薬ともなっています。
セロトニン1A受容体は、セロトニンが結合することによって作用する自己受容体で、セロトニンの放出を抑制する働きを持ちます。そのため、SSRIによってセロトニンの量が増えても、はじめはセロトニン1A受容体の働きによりセロトニンの分泌が抑えられるため、結果として脳内のセロトニンの量に変化はみられません。
ですが、服用を続けることにより徐々にセロトニン1A受容体の反応が低下(脱感作)していきます。するとセロトニンの分泌を抑える働きが弱まるので、最終的に脳内のセロトニンの量が増え、GABA作動性ニューロンが亢進することで、抗不安・抗うつ作用がもたらされます。
これには早くとも2週間以上の期間が必要だとされています。よってこの間は、症状コントロールのためにベンゾジアゼピン系抗不安薬が使用されることが多いです。
SSRIにはフルボキサミン、パロキセチン、セルトラリン、エスシタロプラムの4種類があります。
社会不安障害ではフルボキサミン、パロキセチン、エスシタロプラムが用いられ、パニック障害にはフルボキサミン、パロキセチン、セルトラリンが用いられます。
SSRIの副作用
服用して一週間以内に吐き気・嘔吐といった消化器症状が認められることが多いです。これは腸管のセロトニン受容体が刺激されることにより生じます。他にも性機能障害が認められることがあります。
最も危険な副作用はセロトニン症候群で、錯乱・焦燥・せん妄・筋緊張や反射の亢進・ふるえ・発熱・発汗などの症状がみられ、これは服薬開始時や増量時にみられることが多いです。ただちにSSRIを中止し対応すれば改善していきますが、放置し重症化すると命の危険があるため、注意が必要です。
またSSRI開始時・増量時にはアクチベーション症候群を生じることもあり、症状として不安・焦燥・パニック発作・興奮などがみられます。
SSRIも急に中止するとめまい・不眠・吐き気・頭痛・不安・焦燥などの離脱症状が生じるため、中止する際には徐々に減量していく必要があります。
セロトニン1A部分作動薬
セロトニンの量を増やすのではなく、ダイレクトにセロトニン1A受容体を刺激する薬です。SSRIと同様に受容体を脱感作する必要があるため、作用発現までに2週間程度かかります。
タンドスピロンという薬が該当します。
ベンゾジアゼピン系抗不安薬のように筋弛緩作用、健忘、催眠作用などはなく、依存性も少ないですが、薬効はあまり強くありません。
副作用としてはめまい、ふらつき、眠気などがあります。
ヒスタミンH1受容体拮抗薬
ヒスタミンH1受容体を遮断することにより抗不安・鎮静作用をもたらします。抗アレルギー薬としても用いられており、制吐作用も有しています。
ヒドロキシジンという薬が該当します。
副作用としては眠気、倦怠感、口渇などが挙げられます。
精神療法
不安障害には認知行動療法や支持的療法などが有効とされています。
認知行動療法
物事の受け止め方や考え方、それに伴う行動に対し働きかける治療です。
認知行動療法は多くの精神疾患に有効であり、疾患に応じて様々な方法で治療が行われます。
曝露療法(エクスポージャー法)
社会不安障害や恐怖症などに対して実施されます。敢えて恐怖刺激に曝露することにより、「考えているような恐ろしいことは起きない」ということを理解し、徐々に慣れていくように働きかける治療です。
認知再構成
強い不安が生じた時に、何に対して不安を感じているのかを理解し、肯定的に解釈できるようにします。うつ病や社会不安障害に対し有効とされています。
心理教育
医療従事者とともに、自分の抱える病気の一般知識や症状に対する具体的な対策を学び、自身の症状コントロールに役立てます。
マインドフルネス瞑想
社会不安障害では、人前に出ることによって自分が低く評価されてしまうことを怖れ様々な症状が出現しますが、症状が出現するとその恐怖感がより増強されるため、悪循環となってしまいます。そのようなことを防ぐため、注意を別の方向へと転換する「注意訓練」や、「マインドフルネス瞑想」が用いられます。
マインドフルネス瞑想とは、過去の苦い記憶や自己への否定的イメージから離れて、「今ここにいること」に集中し様々な気づきを得るというもので、うつ病にも効果があるとされています。
他にも、身体の感覚に意識を集中させ、ゆっくりと腹式呼吸を行うことで心をリラックスさせる「呼吸再調整法」や、目一杯筋肉にグッと力を入れた後に、ストンっと力を抜くことによる落差を利用して身体をリラックスさせる「漸進的筋弛緩法」なども、不安障害に有効とされています。
支持的療法
支持的療法とは、強い不安に潰されてしまわないように、肯定的感情を持てるように働きかける治療法です。
例えば、パニック発作が起こった際、「その発作で死ぬことはないから大丈夫ですよ」と声をかけて安全を保証したりすることなどが挙げられます。
何よりも共感的・肯定的に関わりを持てる人が近くにいるだけで、不安障害の人にとっては大きな心の支えとなり、自信の形成にもつながります。
不安とCBD

CBD(カンナビジオール)は大麻に含まれる主なカンナビノイドの1つです。これまでの臨床試験や前臨床試験において、CBDには抗不安作用があることが明らかとなってきています。
研究により一貫性がない部分はありますが、今年7月に公開されたオーストラリアの論文では、CBD単体による抗不安作用は中程度のエビデンスがあると述べられています。
CBD使用者2409名を対象としたアメリカのオンライン調査では、使用理由の上位3つに痛み、不安、うつ病の緩和が挙げられ、35.8%が「非常に効果がある」と回答し、「あまり効果がない」と回答した人は3.6%しかいなかったことが報告されています。
CBDの臨床試験
CBDによる臨床試験は、主に人前でのスピーチによる不安に対して行われており、用量によって効果が異なることが示されています。
2017年の研究では、健康な男女60名をプラセボ、クロナゼパム1mg(ベンゾジアゼピン系抗不安薬)、CBD(100mg、300mg、900mg)といった5つの摂取群に12名ずつランダムに振り分け、それぞれ摂取後にスピーチを行ってもらった結果、クロナゼパムよりは作用は強くなかったものの、CBD300mgの用量で主観的な抗不安作用がみられ、血圧上昇が少なかったことが報告されています。
同じように2019年の研究では、健康な男性57名をCBD150mg(15名)、300mg(15名)、600mg(12名)、プラセボ(15名)摂取群に振り分け、スピーチ前に摂取してもらった結果、CBD300mgの用量でのみ不安の有意な軽減が認められました。
CBD600mgの摂取については、2011年の研究ではプラセボよりも有効であったことが報告されていますが、今年4月に公開された論文ではプラセボと比較して有意差がなかったことが報告されています。
それより少ないCBD400mgの摂取 では、プラセボと比較して主観的不安の有意な減少が認められました。
以上のことから、CBDは摂取量が多すぎても少なすぎても抗不安作用が認められず、中間量である300〜400mgの摂取で抗不安作用を発揮する可能性があると考えられます。
これらは一度きりの使用による話になりますが、継続的な使用では少量でも有効性が認められたことが報告されています。
2019年の後ろ向き研究では、不安あるいは不眠を有する患者72名にCBD25mg(若干名のみ50〜75mg)を毎日朝食後(不眠の人は夕食後)に摂取してもらった結果、始めの1ヶ月で57名(79.2%)に不安の減少が認められ、その効果は3ヶ月間持続しました。
また、CBDを20〜80mg/日の用量で連日摂取したことにより、不安やそれに伴う睡眠障害が改善された4名の症例も報告されています。
一方、今年8月に公開されたオーストラリアの研究では、治療抵抗性の不安障害患者31名に対しCBDを800mg/日までの高用量で12週間使用してもらったところ、不安の有意な軽減が認められています。
また、治療抵抗性の社会不安障害・パニック障害を有する患者に対し、毎週外来受診時に曝露療法の補助としてCBD300mgを摂取してもらい、治療直後・3ヶ月後・6ヶ月後に有効性を評価したところ、プラセボと比較して有意差が認められなかったという報告もあります。
つまりこのことは、週一回程度の使用では有効性がない可能性を示していると考えられます。
CBDの前臨床試験
不安に対するCBDの前臨床試験は数多く行われており、様々なモデルにおいて有効性が報告されています。
例えば2006年の研究では、恐怖条件付けを行ったラットに対しCBDを投与した結果、ベンゾジアゼピン系抗不安薬であるジアゼパムと同様の抗不安作用が認められています。
2012年の研究では、CBDを投与したマウスを蛇と対峙させたところ、回避行動の減少が認められ、CBDに抗パニック作用があることが実証されました。
それ以外にも拘束による急性ストレスと、14日間の慢性ストレスにおける研究において、CBDに抗不安作用が認められたことが報告されています。
このように様々な不安に対し有効性が報告されているCBDですが、必ずしも抗不安作用を示すわけではなく、まだまだ研究が必要な状況となっています。
また、人と同様に動物においてもCBDは用量によって作用が異なることが報告されています。
1990年の研究では、不安の研究のために最も使用されるテストの1つである高架式十字迷路試験において、CBDは2.5mg/kg、5mg/kg、10mg/kgの用量でのみ部分的な抗不安作用を認めましたが、20mg/kgの用量では効果を認めませんでした。
CBDが有効と考えられるメカニズム
CBDが抗不安作用をもたらすメカニズムはまだ明らかとなっていませんが、現時点で分かっていることをお話していきます。
不安とECS
CBDの抗不安作用のメカニズムについてお話する前に、まずは不安とECS(エンドカンナビノイドシステム)との関係性についてお話していきます。
不安や恐怖の出現には扁桃体、海馬、分界条といった大脳辺縁系や中脳水道周囲灰白質などが関与し、不安や恐怖のコントロールには前頭前野などの大脳皮質が関与しますが、これらの脳領域にCB1受容体が存在していることが明らかとなっています。
CB2受容体は主に免疫細胞に存在していますが、大脳皮質や海馬、扁桃体においても発現していることが報告されています。
これまでの研究により、これらの受容体の活性化は抗不安作用をもたらすことが明らかとなってきています。
CB1・CB2受容体を活性化するのは、アナンダミドや2-AGといったエンドカンナビノイド(内因性カンナビノイド)です。
エンドカンナビノイドは必要時にのみ生成され、役目を終えるとそれぞれFAAH(脂肪酸アミドヒドラーゼ)とMAGL(モノアシルグリセロールリパーゼ)により速やかに分解されます。
またアナンダミドはFABP(脂肪酸結合タンパク質)というトランスポーターにより取り込みが行われます。
つまり、CB1・CB2受容体の直接的な活性化や、エンドカンナビノイドの分解酵素やトランスポーターの阻害(エンドカンナビノイドの増加によるCB1・CB2受容体の間接的な活性化)は、抗不安作用をもたらす可能性があるということになります。
2008年の研究では、アナンダミド、アナンダミド取り込み阻害薬、FAAH阻害薬を投与することにより、高架式十字迷路試験によるマウスの不安が軽減され、この作用はCB1受容体拮抗薬により消失したことが報告されています。同じような結果は別のマウスの研究でも報告されています。
2011年の研究では、明暗試験、高架式十字迷路試験において、CB2受容体を過剰発現させたマウスでは不安行動の減少が認められ、興味深いことにベンゾジアゼピン系薬であるアルプラゾラムの抗不安作用を無効化したことが報告されました。これはCB2受容体が不安のコントロールと密接に関係していることを示していると言えるでしょう。
その証拠として今年6月に公開された論文では、マウスにFABP阻害薬を投与することにより、用量依存的に抗不安作用が認められましたが、この作用はCB2受容体拮抗薬により消失しています。
また2013年の研究では、2-AGやMAGL阻害薬をマウスの中脳に投与することにより抗不安作用が認められましたが、この作用はCB1受容体及びCB2受容体それぞれの拮抗薬により阻止されたことが報告されています。この結果は、不安のコントロールにCB1受容体とCB2受容体の両方が必要であることを意味しています。
ストレスとECS
続いてストレスとECSについてお話していきます。前述したように不安障害の多くはストレスに起因しており、ストレスへの対処にECSが大きく関与しているからです。
私たちはストレスを感じると、コルチゾールと呼ばれる副腎皮質(ステロイド)ホルモンを分泌することにより、ストレスに対処しようとします。
コルチゾールは脳からのホルモンにより分泌が調節されています。ストレスを感じた際、まず脳の視床下部から副腎皮質刺激ホルモン放出ホルモン(CRH)が分泌され、それにより脳下垂体から副腎皮質刺激ホルモン(ACTH)が分泌され、この刺激によりようやく副腎皮質からコルチゾールが分泌されます(これをHPA軸と呼びます)。
無事ストレスに対処できたら、副腎皮質刺激ホルモン放出ホルモンの分泌は低下し、それに伴いコルチゾールの分泌も低下します(これをネガティブフィードバックと呼びます)。
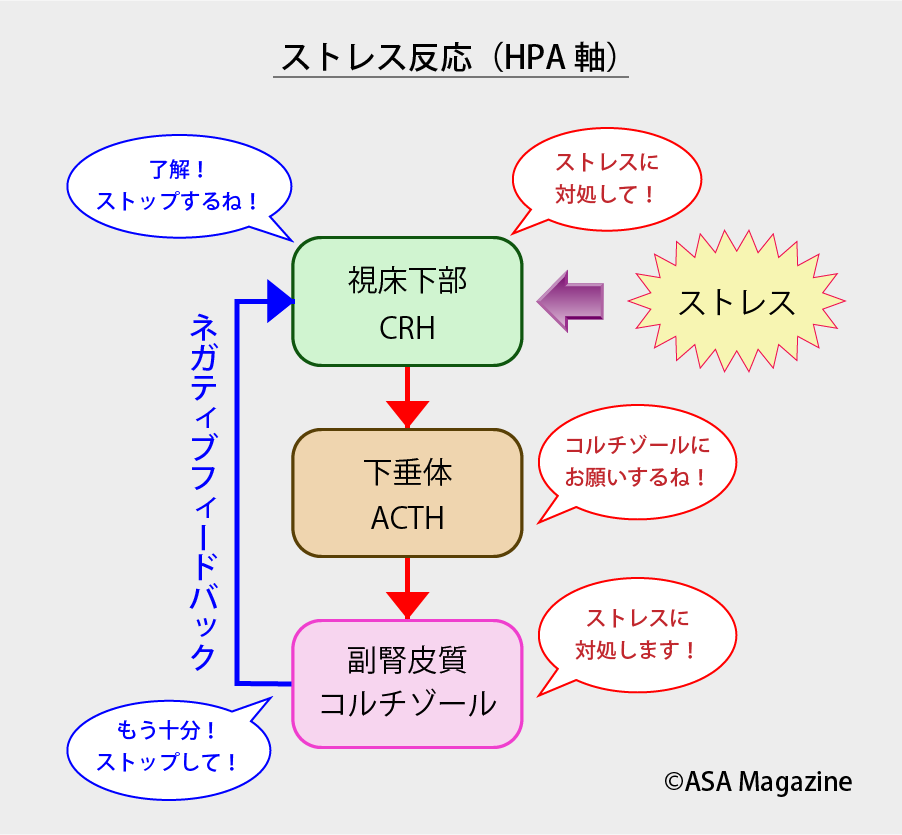
コルチゾールは恒常性維持のために必要なものではありますが、過剰な分泌は脳やからだに悪影響を及ぼすため、このネガティブフィードバックはとても大切なものになります。
ですが、ストレスが慢性的に続いたり、あるいはストレス耐性が元々弱い人では、このネガティブフィードバックがうまく働かなくなることでコルチゾールが過剰な状態となり、結果として不安障害やうつ病を始めとした精神疾患の発症を招いてしまいます。
ではこれらのストレス反応(HPA軸)にECSはどのように関係しているのでしょうか。
2010年の研究では、視床下部にコルチゾールを投与することによりネガティブフィードバックが生じましたが、この作用はCB1受容体拮抗薬の使用により阻害されました。さらに2014年の研究では、前頭前野のCB1受容体の活性化がHPA軸のネガティブフィードバックをもたらしています。
他にもストレスにより脳下垂体において2-AGが上昇し、このことがHPA軸のネガティブフィードバックの開始に関与していたことが報告されています。
つまりこれらは、ECSがHPA軸のネガティブフィードバックにおいて重要な役割を果たしていることを意味します。
もう少し詳しくみていきましょう。
ストレスを受けると、扁桃体や前頭前野ではFAAH活性の上昇によりアナンダミドが減少し、ストレスが慢性化するとこの領域で2-AGが上昇します。また、ストレスによるコルチゾールの上昇とアナンダミドの減少、アナンダミドの減少と不安行動には相関関係があることが報告されています。
さらに慢性ストレスにより視床下部のCB1受容体の機能が低下することや、CB1受容体欠損マウスではストレス下において不安行動が誘発されやすいことが報告されています。
これらのことから、慢性的なストレスはECSの働きを低下させ、HPA軸のネガティブフィードバックを損なわせることにより、不安障害を発症させる可能性があると考えられます。
逆を言えば、ECSの働きを助けることができれば、ストレス性の不安障害に有効かもしれないということになります。
実際に2015年の研究では、FAAHやMAGLの阻害薬によるECSレベルの上昇が、慢性ストレスによるマウスの不安を軽減させています。
特にFAAHの阻害によるアナンダミドレベルの上昇は、ストレス性の不安障害に対し有効である可能性が、多くの研究により報告されています。
2013年のマウスの研究では、慢性ストレスにより扁桃体でFAAH活性の上昇とアナンダミドの減少が生じ不安行動が誘発されましたが、FAAH阻害薬により不安が抑制され、さらにFAAH欠損マウスではそもそも不安が誘発されなかったことが報告されています。
また、直接的にCB1およびCB2受容体に働きかけることも、ストレス性の不安障害に対し有効である可能性があります。
2009年の研究では、FAAH阻害薬はCB1受容体を介してストレス性の不安を緩和し、さらにCB1作動薬自体もストレスによるコルチゾールの上昇を抑制することが明らかとなりました。
2018年のマウスの研究では、慢性ストレスによる不安がCB2逆作動薬では増強、CB2作動薬あるいはフルボキサミン(SSRI)では改善し、またCB2受容体の遺伝子の変異が不安の増強と関連することが示されました。
これらのことを総括すると、ECSの活性化は不安障害の中でも、特にストレスに関連したものに有効である可能性が高いと言えるかもしれません。
ECSを介したCBDの作用
CB1・CB2受容体の活性化やエンドカンナビノイドの量を増やす作用が、不安障害に対し有効である可能性についてお話ししてきました。
続いてCBDがどのようにECSに作用し、抗不安作用をもたらすのかについてお話していきます。
CBDはCB1・CB2受容体に対し親和性が低く、CB1受容体に対してはネガティブ・アロステリック・モジュレーターとして、CB2受容体に対しては逆作動薬あるいは部分作動薬として作用すると考えられています。
CBDはFAAHを阻害し、さらにFABP(脂肪酸結合タンパク質)に結合することでアナンダミドの再吸収を抑制し、体内のアナンダミドの量を増やす働きがあるとされています。要するにCBDは間接的にCB1受容体を活性化する作用も有しているということになります。
このようにCBDはECSを活性化することから、不安障害に対し有効である可能性があります。
2013年の研究では、慢性ストレスモデルマウスにおいて、CBDは海馬のアナンダミドレベルを上昇させ、CB1受容体を介して不安を減少させたことが報告されています。似たようなことは2008年の研究でも報告されています。
2022年4月の研究では、CBDの抗不安作用はCB1受容体拮抗薬で阻止され、CB1受容体欠損マウスではそもそも作用が認められなかったことが報告されています。なおこの研究において、CB2受容体欠損マウスでは抗不安作用が阻止されることはありませんでした。
これらのことから、CBDの抗不安作用にはCB1受容体が大きく関わっている可能性があると考えられます。
セロトニンへの作用
前述したように、不安障害の治療にはセロトニンの量を増やすSSRIや、セロトニン1A受容体部分作動薬が使用されています。
2005年の研究において、CBDはセロトニン1A受容体を活性化させることが示されています。このことからCBDの抗不安作用はセロトニン1A受容体の活性化によりもたらされている可能性があると考えられるようになりました。
実際に高架式十字迷路試験、パニック障害、拘束ストレスによる不安、恐怖条件付けにおけるCBDの抗不安作用は、セロトニン1A受容体拮抗薬により消失しています。
ECSは主に抑制系の神経伝達物質であるGABA(γアミノ酪酸)の放出を抑制しますが、それだけでなく興奮系の神経伝達物質であるグルタミン酸の放出も抑制するため、これに伴いセロトニン神経の活動も双方向に調節されると考えられています。
CB1受容体は脳のいくつかの場所においてセロトニン神経と共発現しており、2015年の研究では、セロトニン神経のCB1受容体を欠損させたマウスにおいて不安の増強や社交性の低下が認められたことが報告されています。
2011年の研究では、FAAH欠損マウスは通常のマウスと比べて不安レベルが低く、セロトニンレベルが高くなっていたことから、アナンダミドがセロトニンレベルの上昇と情動に関連している可能性が示されました。
これらのことから、CBDはセロトニン1A受容体の活性化やECSを通じたセロトニンへの働きかけにより、抗不安作用をもたらしている可能性があると考えられます。
不安と医療用大麻

不安に対する医療用大麻の使用は、痛みに次いで2番目に多くなっています。
例えば、ワシントン州における医療用大麻使用者1429名に対する調査では、使用理由として最も多かったのは痛みで(61.2%)、2番目に不安が挙げられていました(58.1%)。
また、2019年に公開されたメタアナリシスでも、医療用大麻の使用理由として最も多かったのは痛み(64%)であり、不安(50%)は2番目となっていました。
上記で不安障害の治療薬について紹介しましたが、これらの治療薬の代わりに大麻を使用する人も多くみられます。
アメリカのニューイングランドにおける調査では、医療用大麻使用者1513名のうち、71.8%において抗不安薬の処方量が減少していたことが分かりました。また、アメリカにおける州レベルの嗜好用大麻の合法化が、抗不安薬を含む様々な処方薬の減少をもたらしたという報告もあります。
ですが、実際のところ、大麻の抗不安作用はまだエビデンスとしては確立していません。それどころか、大麻の使用は逆に不安障害を引き起こす原因となり得ることも指摘されています。
大麻は不安を誘発する?
大麻使用者の間でよく言われる「バッドトリップ」。大麻や幻覚剤の使用により生じる一過性の不快症状のことで、具体的な症状として不安や恐怖感、パニック発作などがあります。これらは特に摂取量が多かった場合に認められることが多いです。
「大麻に含まれているCBDには抗不安作用があるのでは?」と疑問に思う方がいるかもしれませんが、大麻による不安の誘発は酩酊作用のあるTHC(テトラヒドロカンナビノール)によりもたらされると考えられています。
こう言うとTHCが悪者みたいに聞こえてしまいますが、そういうわけではありません。健康な大麻使用者16名を対象に行った研究では、THCとプラセボによる比較試験において、THCが扁桃体の反応を有意に低下させたことが報告され、これは不安に有効であることを示しています。
また、最近公開された米ペンシルベニア州における調査では、回答者の約半数が不安障害のために医療用大麻を使用し大幅な改善を報告しましたが、効果があった大麻(製品)の種類として最も多く挙げられていたのは、THC単体あるいはTHC優位のものでした。
CB1・CB2受容体の活性化が不安障害に対し有効である可能性については、「不安とECS」の項でお話したとおりです。THCはCB1・CB2受容体に対し部分的に作用することから、抗不安作用を有していても不思議ではありません。
つまり大麻には、抗不安作用と不安誘発作用といった2側面の作用があるということになります。
そのため大麻使用時には不安の誘発を避けるために、自身の心や周囲の環境を整えること(セットとセッティング)が重要であると言われてます。
大麻が相反する作用を有する理由
THCなどCB1受容体を活性化する成分は、低用量で不安を緩和し、高用量で不安を誘発すると考えられています。
では、なぜこのような相反する作用が認められるのでしょうか。
その答えはまだ明らかとなっていませんが、現時点では「GABAとグルタミン酸」、「CB1受容体とTRPV1」が関与していると考えられています。おそらくこれらは、CBDの用量依存的な抗不安作用にも関連している可能性があります。
GABAとグルタミン酸
私たちの生命活動は細胞の働きにより成り立っています。細胞の活動は電気信号のやりとりによって行われていますが、この際に放出されるのがGABA(γアミノ酪酸)やグルタミン酸などの神経伝達物質です。
GABAは神経細胞のブレーキとして、グルタミン酸はアクセルとしての役割を果たし、これらのバランスが保たれることにより、私たちは心身の恒常性を保つことができています。前述したように、ベンゾジアゼピン系抗不安薬はGABAの働きを増強することで感情の高まりにブレーキをかけ、不安を抑制します。
CB1受容体は脳を中心に様々な神経細胞上に分布。主にGABA作動性ニューロン上に存在し、グルタミン酸作動性ニューロン上にも存在しています。
これらのCB1受容体が活性化されると、GABAとグルタミン酸の放出は抑制されます。これは「GABAによるブレーキを緩める」「グルタミン酸による興奮を抑える」といった2種類の効果を生み出すことを意味しています。
つまり不安について言えば、基本的にGABAの抑制は「不安誘発作用」、グルタミン酸の抑制は「抗不安作用」をもたらすということになります。
実際に2012年のマウスの研究では、低用量のCB1作動薬による抗不安作用はグルタミン酸作動性ニューロンのCB1受容体を欠損させることで消失し、一方で高用量のCB1作動薬による不安誘発作用はGABA作動性ニューロンのCB1受容体を欠損させることで消失したことが報告されています。
また2008年の研究では、不安を誘発させたマウスに対しジアゼパム(ベンゾジアゼピン系薬)だけでなくCB1作動薬を併用することにより、抗不安作用が増強したことが報告されています。この効果はジアゼパムの抑制性シグナルの増強に加え、CB1作動薬がグルタミン酸の放出を抑制したことにより認められた可能性があります。
なお、GABA作動性ニューロンとグルタミン酸作動性ニューロン上のCB1受容体はそれぞれ感受性が異なり、2002年のラットの研究では、海馬においてグルタミン酸よりもGABA作動性ニューロン上のCB1受容体の方が感度が高かったことが報告されています。ただし興味深いことに、グルタミン酸作動性ニューロン上のCB1受容体は感受性が均一であったのに対し、GABA作動性ニューロン上のCB1受容体は高い感受性を持つものと、全く反応しないものが存在したそうです。
複雑で矛盾してそうな部分もありますが、以上のことから、大麻はGABAとグルタミン酸といった2つの側面に作用することにより、不安に対し相反する作用をもたらしている可能性があります。
CB1受容体とTRPV1
TPPV1とはイオンチャネル型受容体の1つで、唐辛子に含まれるカプサイシンや熱・寒冷刺激に反応し、痛みを媒介する働きがあります。
TPRV1は不安にも関連し、実際にマウスの研究では、TRPV1の欠損や拮抗薬の使用により不安が減少したことが報告されています。このことから、この受容体の働きを抑えることは抗不安作用をもたらすと推測されます。
TPRV1は脳内のいくつかの領域においてCB1受容体と共に発現しており、このことは不安と関連する扁桃体、海馬、前頭前野などの脳領域においても確認されています。そしてこの受容体は、主要なエンドカンナビノイドの1つであるアナンダミドにより活性化することが明らかとなっています。
前述したように、CB1受容体の活性化は抗不安作用をもたらします。つまり、CB1受容体とTPRV1は両方ともアナンダミドで活性化するにも関わらず、相反する作用が認められるということになります。
マウスを用いた研究では、アナンダミドの低用量はCB1受容体を介して抗不安作用をもたらす一方、高用量ではTPRV1を介して不安を誘発させたことが報告されています。
さらに別のマウスの研究では、CB1作動薬とCBDは低用量で不安を減少させ、高用量では作用が消失しましたが、TRPV1拮抗薬との併用により、高用量でも抗不安作用が認められています。
つまり、大麻はCB1受容体とTRPV1の両方を活性化するため、不安に対し相反する作用をもたらす可能性があるということになります。
なお、現時点でTHCが直接TRPV1を活性化するといった研究報告はなされていないようです。
様々な成分が不安を和らげる
大麻に含まれている主なカンナビノイドはTHCとCBDです。
前述したようにTHCは不安に対し2側面の作用をもたらすため、場合によっては不安を悪化させることもあります。ですが同じ大麻に含まれているCBDは、THCの不利益な作用を緩和すると言われています。
1974年の研究では、40名の健康な大人にTHC30mg、CBD15・30・60mg、THC30mg+CBD15・30mgのいずれかを摂取してもらった結果、THCのみでは不安が誘発され、CBDのみでは変化なし、THCとCBDの混合ではTHCによる不安が誘発されなかったことが報告されています。これと同じような報告は最近公開されたオランダの研究や1982年の研究においてもなされています。
また、2011年の研究では、CBD、CBG(カンナビゲロール)、CBGV(カンナビゲロールバリン)、THCV(テトラヒドロカンナビバリン)といったカンナビノイドがTRPV1を刺激し、脱感作(受容体の作用を低下)させたことが報告されています。これはこれらのカンナビノイドがTRPV1を介した不安の誘発を緩和する力があることを意味してします。
このようなことから、大麻に含まれる様々な成分はお互いの負の部分をサポートし合うと考えられています。
THCやCBD以外のカンナビノイドでは、CBDA(カンナビジオール酸)がセロトニン1A受容体を介して抗不安作用をもたらしたことが報告されています。
CBG主体の大麻を使用している人127名を対象とした調査では、最も多い使用理由として不安の緩和(51.2%)が挙げられ、78.3%の人が処方薬よりも有効であることを報告しました。
また、大麻を含め植物にはテルペンと呼ばれる香り成分が含まれており、これらにも抗不安作用があることが示されています。大麻に含まれるテルペン単体で抗不安作用を検証した研究はあまりありませんが、リモネン、リナロール、β-ピネン、α-ピネンにおいて有効性が報告されています。
大麻にはこれらの成分が全て含まれています。大麻そのものを摂取すると、様々な成分が体内で入り混じることで、作用の増強、副作用の軽減、あるいは成分単体では認められない新たな作用が認められる可能性があります。これをアントラージュ効果と呼び、成分単体で摂取するよりも望ましい効果をもたらすと考えられています。
ただし、このことは大麻に含まれる成分の種類や濃度の違いにより、同じ大麻でも異なる効果がもたらされる可能性があることも意味しています。
現段階でどのような大麻を選択すれば良いのかは分かりませんが、不安を和らげるために適切な大麻を選択することができれば、アントラージュ効果により大きな治療効果を得ることができるかもしれません。
まとめ
不安障害、そしてCBD・医療用大麻の有効性についてお話してきました。
以上のことをまとめると
・不安は生きるために必須なものだが、過剰になると生活に支障をきたす。
・不安障害に対する根治治療はなく、既存の抗不安薬では副作用や依存性が問題となる場合がある。
・ECSは不安や恐怖、ストレス反応の調節に関与している。
・CBDは単回投与では300〜400mg/回、連日の使用では25mg/日で有効な可能性がある。
・大麻には抗不安作用・不安誘発作用の2側面の作用がある。
・大麻に含まれる成分や濃度の組み合わせによっては、より大きな恩恵を受けたり、不利益な作用を引き起こすリスクを軽減できる可能性がある。
前述したように、不安障害の治療に用いられるベンゾジアゼピン系抗不安薬は効果発現が早く、有効性も高いです。しかし依存性の問題から、早期に使用をやめることが推奨されています。
それにも関わらず実際の臨床現場では、漫然とこの薬が処方され続けている患者さんが多く、これは精神科において大きな問題点となっています。
とはいえ、他の薬を使用することで改善が見られない人が一定数いるのも事実です。そのため、既存の標準治療薬以外の代替となる薬が待ち望まれています。
そこに希望の光を照らすものの1つとして大麻があると思います。もちろん大麻は根治治療をもたらすものではないし、現時点で確固たるエビデンスは示されていませんが、現行治療で効果がない人や薬の副作用で苦しんでいる人々にとっての選択肢として存在しても良いのではないでしょうか?
また、不安障害をはじめとした精神疾患の多くはストレスに起因しています。ストレス解消方法は人によって色々あると思いますが、その手段として「飲酒」を挙げる人は少なくないのではないでしょうか?そう考えると大麻がもたらす多幸感も、人によってはストレスから解き放たれるための手段となり得ると思います。
察しの通り、これは「医療用大麻」では実現できません。なぜなら、医療用大麻はストレスに対してではなく、ストレスにより発症した病気に対し処方(ライセンスが発行)されるからです。ですが本来は、病気になる前のストレスにさらされている段階で対処することが大切なはずです。
もちろん運動や瞑想などのコーピング行動だけで解決できればそれが一番ですが、その中の1つとしてお酒と同じように大麻があっても良いのではないでしょうか?世の中には好みやアレルギーの問題で、お酒が飲めない人も数多くいるのですから。
そのため、病気になる以前から大麻を使用できるような法整備、つまりは嗜好用大麻が合法化されることが望ましいと、筆者は考えています。